Металлы. Свойства, характеристики металлов
Металлы (от лат. metallum – шахта, рудник, копь) – наиболее широко используемый класс конструкционных материалов, применение которых наряду с неметаллами и композитами позволяет решать почти любые технологические задачи. К металлам принято относить элементы, обладающие характерными металлическими свойствами (высокой тепло- и электропроводностью, повышенной пластичностью и т. д.).
Число элементов, проявляющих свойства металлов, гораздо больше по сравнению с числом элементов, характеризующихся неметаллическими свойствами. Металлы расположены в I и II группах Периодической системы Д. И. Менделеева, а также образуют побочные подгруппы III–VIII групп. Ряд элементов проявляет амфотерные свойства (амфотерность – двойственность, способность некоторых соединений в зависимости от условий демонстрировать как кислотные, так и основные свойства).
Металлические свойства элементов определяются способностью атомов при взаимодействии с атомами других элементов частично или полностью смещать к ним электронные облака или «отдавать» электроны, т. е. проявлять при взаимодействии восстановительные свойства.

К самым активным металлам относятся элементы, обладающие:
- низкой энергией ионизации;
- большим радиусом атома;
- малым числом внешних электронов;
- небольшим значением электроотрицательности.
По мере заполнения внешнего энергетического уровня электронами их число на валентном уровне атомов элементов растет, а радиус атомов уменьшается, поэтому в большей степени проявляется склонность атомов к присоединению, а не к отдаче электронов. В связи с этим в периоде при движении слева направо металлические свойства элементов постепенно уменьшаются, а неметаллические – увеличиваются.
Имея больший радиус атома, металлы характеризуются, как было сказано выше, сравнительно низкими значениями энергии ионизации, сродства к электрону и электроотрицательности. Эти особенности влияют на преобладание у металлов восстановительных свойств, т. е. способности их атомов отдавать электроны. Ярче всего восстановительные свойства выражены у атомов металлов I и II групп главных подгрупп или у s-элементов. Самым сильным восстановителем является франций, а в водной среде – литий, выделяющийся за счет более высокого значения энергии гидратации образующихся катионов металла.
Число элементов, проявляющих металлические свойства, внутри периодов возрастает по мере увеличения номера периода. Так, во втором периоде это два элемента, в третьем – три, в четвертом – тринадцать и т. д.
В Периодической таблице металлические элементы отделены от неметаллических диагональной линией, проходящей от бора к астату. Вдоль этой границы располагаются элементы, одновременно проявляющие свойства и металлов, и неметаллов. К ним относятся бор, кремний, германий, мышьяк, сурьма, теллур и астат, которые называются полуметаллами или металлоидами. Таким образом, внутри каждого периода имеется «пограничная зона», где располагается элемент, имеющий двойственные свойства. Соответственно переход от типичного металла к типичному неметаллу в периоде происходит постепенно.
Начиная с 3-го периода у атомов появляются новые подуровни. Поэтому увеличивается число свободных орбиталей и, следовательно, возрастает между атомами количество связей, способствующих образованию сложных молекул, таких как комплексные соединения. В комплексных соединениях связь чаще всего образуется по донорно-акцепторному механизму. В роли акцептора, как правило, выступает положительно заряженный ион металла. Практически все элементы могут исполнять роль комплексообразователя, но наибольшее число комплексных соединений характерно для d-элементов 4-, 5- и 6-го периодов системы. Следовательно, элементы побочных подгрупп (В) более склонны к комплексообразованию, чем элементы главных подгрупп (А).
1. Физические свойства металлов
Почти все металлы, за исключением франция и ртути, в стандартных условиях находятся в твердом состоянии. При нагревании до определенной температуры они плавятся, а при еще более высоких температурах переходят в газообразное состояние.

Твердость металлов, а также их температура плавления обусловлены прочностью пространственной кристаллической решетки. Самые мягкие – щелочные металлы, которые легко режутся ножом. Наиболее твердые – металлы VIВ группы, особенно хром; по твердости он приближается к алмазу и режет стекло.
Изменение температуры плавления можно проследить по таблице Д. И. Менделеева: каждый период начинается с металла, имеющего очень низкий показатель. По мере увеличения заряда ядра атома температура плавления растет и достигает максимума в группе хрома, где находится самый тугоплавкий металл – вольфрам (3390 °С). Далее она снижается
и достигает минимума в подгруппе цинка, где находится самый легкоплавкий металл – ртуть (–38,9 °С). Металлы, температуры плавления которых выше 1000 °С, называют тугоплавкими, а ниже 100 °С – легкоплавкими.
Металлический блеск является следствием отражения световых лучей, а его интенсивность определяется долей поглощаемого света. Большинство металлов почти полностью отражают свет всех длин волн спектра, в связи с чем имеют белый или серый цвет. Наиболее ярко блестят палладий и серебро. Некоторые металлы (медь, золото, цезий) поглощают зеленый или голубой свет сильнее, чем свет других длин волн, поэтому окрашены в желтый или красный цвета.
В мелкораздробленном состоянии многие металлы теряют блеск. Например, железо, платина, хром становятся черного или серого цвета, тогда как алюминий и магний в порошкообразном состоянии продолжают блестеть. Интенсивность блеска зависит от доли поглощенного света: чем меньше света поглощает металл, тем более интенсивным будет блеск.
Все металлы полностью отражают радиоволны, что используется для обнаружения различных металлических объектов с помощью радиоволн (радиолокация).
Теплота сублимации – это характеристика, представляющая собой энергию, необходимую для перевода определенной массы металла в парообразное состояние. Теплота сублимации является мерой прочности связи в кристаллической решетке металла. В каждом периоде таблицы Д. И. Менделеева с увеличением порядкового номера теплота сублимации возрастает и достигает максимума для металлов подгруппы хрома, затем снижается до минимального значения в подгруппе цинка. Характер изменения значений теплоты сублимации в побочных подгруппах аналогичен изменению температур плавления и кипения металлов.
Электропроводность обусловлена присутствием в металле свободных электронов, которые направленно перемещаются при наложении электрического тока. Металлы – проводники 1-го рода, поскольку проводят электрический ток без изменений своей структуры. При нагревании электропроводность уменьшается, так как усиливается колебательное движение ионов, что затрудняет движение электронов. При охлаждении же электропроводность возрастает. Вблизи абсолютного нуля она стремится к бесконечности – это так называемое явление сверхпроводимости.
Теплопроводность – это свойство металлов, обеспечиваемое взаимодействием электронов проводимости с ионами, находящимися в узлах кристаллической решетки. Теплопроводность связана с электропроводностью: у металлов с высокой электропроводностью теплопроводность так же высока.
Пластичность металлов представляет собой легкость деформации, особенно проявляющуюся при высоких температурах. Обусловлена она тем, что под внешним воздействием одни слои в кристаллах легко перемещаются (скользят) относительно других без разрыва. Благодаря этому большинство металлов прокатывается в листы, вытягивается в проволоку, поддается ковке, прессованию и т. д. Наиболее пластичны золото, серебро и медь. Механически прочные металлы деформируются только под воздействием больших нагрузок.
Плотность – это критерий, лежащий в основе разделения металлов на легкие и тяжелые. Металлы, плотность которых меньше 5 г/см 3 , условно принято называть легкими, а более 5 г/см 3 – тяжелыми. Самый легкий из металлов – литий (плотность 0,53 г/см 3 ), а самый тяжелый – осмий (плотность 22,6 г/см 3 ). К легким относятся щелочные, щелочноземельные металлы, а также бериллий, алюминий, скандий, иттрий и титан, а к тяжелым – все остальные.
Плотность металлов связана с температурой их плавления. Легкие металлы обычно самые легкоплавкие, например, цезий с плотностью 1,87 г/см 3 плавится при температуре +28 °С, а вольфрам с плотностью 19 г/см 3 имеет температуру плавления, равную +3380 °С.
Фотоэлектрический эффект – это свойство металлов выбрасывать электроны с поверхности под действием электромагнитных волн, что обусловлено слабой связью валентных электронов с ядром. Чем слабее эта связь, тем меньше энергии необходимо для отрыва электрона. Именно поэтому в щелочных металлах фотоэлектрический эффект выражен сильнее.
На границе раздела двух металлов возникает контактная разность потенциалов, вызванная различной концентрацией электронов проводимости и разной работой выхода электронов у соприкасающихся поверхностей.
Полиморфизм – это явление существования металла в разных формах в твердом состоянии, или способность принимать различные кристаллические формы. Полиморфные модификации отличаются как внутренней структурой, так и физическими свойствами. Например, у железа известны α-, β-, γ-формы. Модификация α- железа устойчива при низких температурах, β– при более высоких.
Магнитные свойства присущи фактически всем металлам, поскольку они являются магнетиками – веществами, изменяющими или приобретающими магнитный момент под действием внешнего (стороннего) магнитного поля. Мерой измерения магнитных свойств металлов служат следующие величины: остаточная индукция, коэрцитивная сила и магнитная проницаемость (магнитная восприимчивость).
Металлы по магнитным свойствам могут быть разделены на три основные группы:
- диамагнетики – выталкиваются из магнитного поля и ослабляют его;
- парамагнетики – втягиваются магнитным полем, незначительно усиливая его;
- ферромагнетики – усиливают магнитное поле на порядки величин.
К диамагнетикам относятся такие металлы, как медь, серебро, золото, кремний, бериллий и металлы подгруппы цинка, галлия, германия. Им свойственна отрицательная магнитная восприимчивость, поскольку под действием внешнего магнитного поля в них возникает намагниченность, направленная ему навстречу. Парамагнетики – металлы с небольшой положительной восприимчивостью (в основном щелочные и щелочноземельные), которые намагничиваются в направлении внешнего поля. Ферромагнетики включают металлы, обладающие высокой магнитной восприимчивостью – это железо, кобальт, никель. Есть металлы и сплавы, которые не принадлежат трем упомянутым группам: антиферромагнетики (ряд редкоземельных металлов), ферриты (соединения оксида железа) и т. д.
Металлы, применяемые в технике, подразделяются на черные (железо и его сплавы), цветные (все остальные, включая магний и алюминий), драгоценные (золото, платина, палладий, иридий), редкие (цирконий, иттрий, лантан, церий и др.).
2. Типы кристаллических решеток
Все металлы в твердом состоянии представляют собой кристаллы. Кристалл – это совокупность атомов, расположенных в пространстве не хаотично, а в геометрически правильной последовательности. Пространственное расположение атомов и образует кристаллическую решетку.
В узлах пространственной кристаллической решетки металла правильно расположены положительно заряженные ионы, а между ними перемещаются свободные электроны – электронный газ. Переходя от одного катиона к другому, они осуществляют связь между ионами и превращают кристалл металла в единое целое. Эта связь, называемая металлической, возникает между атомами металлов за счет перекрывания электронных облаков внешних электронов. Металлическая связь отличается от неполярной ковалентной связи своей ненаправленностью. В кристалле металлического типа электроны не закреплены между двумя атомами, а принадлежат всем атомам данного кристалла, т. е. делокализованы. К особенности структуры металлических кристаллов относятся большие координационные числа – 8÷12, которым соответствует высокая плотность упаковки.
Кристаллическая решетка каждого металла состоит из положительно заряженных ионов одинакового размера, расположенных в кристалле по принципу наиболее плотной упаковки шаров одинакового диаметра.
Различают три основных типа упаковки, или кристаллической решетки.
1. Объемноцентрированная кубическая решетка с координационным числом, равным 8 (натрий, калий, барий). Атомы металла расположены в вершинах куба, а один – в центре объема. Плотность упаковки шарообразными ионами в этом случае составляет 68 %.
2. Гранецентрированная кубическая решетка с координационным числом, равным 12 (алюминий, медь, серебро). Атомы металла расположены в вершинах куба и в центре каждой грани. Плотность упаковки – 74 %.
3. Гексагональная решетка с координационным числом 12 (магний, цинк, кадмий). Атомы металла расположены в вершинах и центре шестигранных оснований призмы, а еще три – в ее средней плоскости. Плотность упаковки – 74 %.
Из-за неодинаковой плотности атомов в различных направлениях кристалла наблюдаются разные свойства. Это явление, получившее название анизотропия, характерно для одиночных кристаллов – монокристаллов. Однако большинство металлов в обычных условиях имеют поликристаллическое строение, т. е. состоят из значительного числа кристаллов, или зерен, каждое из которых анизотропно. Разная ориентировка отдельных зерен приводит к усреднению свойств поликристаллического металла.
Особенности кристаллических решеток обусловливают характерные физические свойства металлов.
3. Характеристика химических свойств металлов
3.1. Восстановительная способность
Все металлы в свободном состоянии – восстановители, поэтому в соединениях их степени окисления всегда положительны. Химическая активность металлов, т. е. их способность отдавать электроны, может быть охарактеризована с помощью двух величин: энергии ионизации и стандартного электродного потенциала. Различие между этими величинами заключается в том, что энергия ионизации влияет на процесс отрыва электрона от атомов металлов в газовой фазе, а электродные потенциалы изменяют свойства металлов в растворах.
Энергия ионизации (Еи) – энергия, необходимая для удаления электрона из изолированного атома на бесконечно большое расстояние:
Электродный потенциал (Е 0 ) количественно характеризует способность металла отдавать электроны в растворе, т. е. его восстановительные свойства:
Интенсивность взаимодействия металлов с элементарными окислителями определяется не только энергией ионизации атома металла, но и энергией сродства к электрону, и энергией диссоциации молекулярного окислителя. Последнее служит объяснением более легкого окисления металлов галогенами, чем кислородом или азотом, обладающими высокими значениями сродства к электрону.
Внутри каждого периода таблицы Д. И. Менделеева при движении слева направо энергия ионизации повышается: наименьшей энергией характеризуется щелочной металл, а наибольшей – благородный газ. Тогда как в пределах одной группы с возрастанием заряда ядра энергия ионизации, наоборот, уменьшается, так как радиус атома увеличивается, а притяжение электрона к ядру ослабевает. Следовательно, в периоде восстановительная способность атомов элементов уменьшается, а в группе увеличивается.
Все металлы окисляются фтором и могут окисляться хлором. Большинство из них, кроме золота и платины, окисляются бромом в кислой среде. Продуктами такого взаимодействия являются высшие галиды металлов.
С кислородом металлы взаимодействуют менее энергично, что объясняется высоким значением энергии диссоциации его молекулы. Продуктами такого взаимодействия являются, как правило, оксиды, хотя в некоторых случаях возможно образование пероксидов.
С азотом многие металлы вообще не взаимодействуют. Лишь некоторые, способные гореть в атмосфере азота, образуют нитриды. Такая устойчивость обусловлена высокой энергией диссоциации молекулы азота. Атомарный же азот легко взаимодействует со многими металлами с образованием нитридов.
С серой почти все металлы взаимодействуют при нагревании. Особенно легко они реагируют на расплавленную серу. Продуктами такого взаимодействия являются сульфиды металлов.
С водородом активные металлы взаимодействуют с образованием гидридов. Легкость перехода атомов металлов в гидратированные ионы зависит не только от химической активности металла, но и от энергии гидратации его иона.
Сравним свойства двух металлов: лития и цезия. Оба они относятся к s-элементам I группы, но литий находится во втором периоде, а цезий – в шестом. Поскольку радиус атома цезия больше, чем радиус атома лития, то энергия ионизации лития (5,39 эВ) больше, чем цезия (3,89 эВ). Ионы лития лучше гидратируются, благодаря чему в водных растворах он является более сильным восстановителем. А вот в твердом виде наиболее активным металлом и эффективным восстановителем становится цезий.
Металлы при взаимодействии с кислородом (прямом или косвенном) образуют основные оксиды, гидроксиды которых проявляют основные свойства: металл (Ме) → основной оксид (МехОу) → гидроксид или [Ме(ОН)х] основание. Например:
Оксид и гидроксид кальция проявляют основные свойства, поэтому могут взаимодействовать с кислотными оксидами и с кислотами:
В периоде основные свойства оксидов и гидроксидов уменьшаются:
В группе основные свойства соединений увеличиваются:
Если металл может образовывать соединения с разными степенями окисления, то свойства соединений будут зависеть от степени окисления элемента.
С возрастанием степени окисления металла основные свойства соединений уменьшаются, а кислотные свойства увеличиваются:
Взаимодействие металлов с водородными соединениями зависит от агрегатного состояния водородного соединения и от температуры. В основном галогенводороды реагируют с металлами при высокой температуре. При этом образуются соответствующие галиды металлов и выделяется водород:
С активными металлами данная реакция протекает при обычной температуре.
Взаимодействие металлов с водой определяется их активностью. Активные металлы вытесняют водород из воды при комнатной температуре:
Действие воды на металлы усиливается в присутствии кислорода. Если малоактивные металлы в обычных условиях с водой не взаимодействуют, то в присутствии растворенного кислорода достаточно легко окисляются:
Сероводород (H2S) взаимодействует с металлами преимущественно при высоких температурах с выделением водорода и образованием сульфидов, а в случае активных металлов – гидросульфидов.
Газообразный аммиак (NH3) действует на металлы также при высоких температурах, образуя при этом нитриды или гидронитриды (амиды) металлов. Однако жидкий аммиак активными металлами разлагается:
Образование пассивных пленок. Взаимодействие многих металлов с фтором, хлором, бромом и кислородом тормозится пассивными пленками. Они образуются на поверхности металла и имеют особую структуру, благодаря которой обладают такими свойствами как прочность, высокая плотность, инертность и т. д. Наибольшая склонность к пассивации отличает алюминий, бериллий и d-металлы: титан, хром, железо.
Токсичность. Пыль и пары многих металлов являются токсичными. Примером могут служить бериллий, ртуть, свинец, кадмий, серебро, никель, таллий, радий, индий и т. д. Степень токсичности определяется значением предельно допустимой концентрации (ПДК). Так, для бериллия ПДК = 10 –3 мг/м 3 , для таллия – 10 –1 мг/м 3 .
Комплексообразование. Большинство металлов являются комплексообразователями за счет вакантных (свободных) орбиталей: [Cu(NH3)4]Cl2; K2[HgI4].
Способность к комплексообразованию возрастает с увеличением заряда иона-комплексообразователя и уменьшением его радиуса.
3.2. Отношение металлов к кислотам
Взаимодействие с серной кислотой – H2SO4
1. Разбавленная H2SO4. Окислителем в разбавленной серной кислоте является ион водорода Н + . Следовательно, в реакцию могут вступать металлы, чей
стандартный электродный потенциал меньше, чем у водорода (Е 0 Me > Е 0 H = 0) :
2. Концентрированная H2SO4. Окислителем в этом случае является атом серы со степенью окисления +6 – S +6 . В зависимости от активности металла реакция может быть разной:
- металлы низкой активности (Е 0 Me< Е 0 H ) восстанавливают серную кислоту до диоксида серы:
- металлы средней активности, для которых справедливо соотношение Е 0 Mn = – 1,05 ≤ Е 0 Me< Е 0 H, восстанавливают серу серной кислоты до простого вещества:
- металлы высокой активности ( Е 0 Me< Е 0 Mn ) вытесняют из серной кислоты сероводород, в котором степень окисления серы минимальна и равна – 2:
Взаимодействие с азотной кислотой – HNO3
1. Разбавленная HNO3. Окислителем в азотной кислоте всегда является атом N +5 , поэтому при взаимодействии с металлами из нее никогда не выделяется водород. Возможны три варианта взаимодействия металлов разной активности с разбавленной HNO3:
- металлы низкой активности ( Е 0 Me >Е 0 H ) способны восстанавливать азот азотной кислоты до степени окисления +2:
- металлы средней активности ( Е 0 Mn = – 1,05 ≤ Е 0 Me< Е 0 H) восстанавливают азотную кислоту до простого вещества N2 (или до закиси азота N2O):
- металлы высокой активности ( Е 0 Me< Е 0 Mn) способны восстановить азот азотной кислоты до минимальной степени окисления –3:
2. Концентрированная HNO3. В этом случае различают лишь два варианта взаимодействия с металлами:
- металлы низкой активности ( Е 0 Me >Е 0 H) восстанавливают азотную кислоту до диоксида азота NO2, в котором степень окисления азота равна +4:
- активные металлы (Е 0 Ме< Е 0 Н) при растворении в концентрированной кислоте выделяют из нее оксид азота (II):
Такие металлы, как Fe, Al, Cr, Ti не взаимодействуют с концентрированной HNO3 вследствие явления пассивации.
Разложение нитратов металлов разной активности. От активности металла зависит состав продуктов разложения солей азотной кислоты. Возможны три варианта термического разложения нитратов металлов разной активности:
- стоящие в ряду напряжений до Mg при разложении образуют соответствующие нитриты и кислород: MeNO3 → MeNO2 + O2;
- расположенные в ряду напряжений в диапазоне «Mg – Cu» разлагаются с образованием соответствующих оксидов, диоксида азота и кислорода: MeNO3 → MeO + NO2 + O2;
- находящиеся в ряду напряжений после Cu разлагаются с выделением металла в виде простого вещества, диоксида азота и кислорода: MeNO3 → Me + NO2 + O2.
4. Металлические сплавы
В твердом состоянии металлы практически не взаимодействуют друг с другом, однако в расплавленном состоянии могут иметь место и растворение, и взаимодействие. Различные расплавленные металлы в большинстве случаев смешиваются друг с другом в любых соотношениях, образуя жидкие однородные системы. В отдельных случаях наблюдается неполная взаимная растворимость. Например, расплавленные цинк и свинец при смешивании образуют двухслойную жидкую систему, фазы которой представляют собой растворы цинка в свинце и свинца в цинке.

Отличительные признаки смешанных металлических расплавов проявляются в процессе их кристаллизации при охлаждении в некотором температурном интервале. Система при этом затвердевает, образуя металлический сплав.
Металлические сплавы – это вещества, обладающие свойствами металлов и состоящие из двух и более компонентов, из которых хотя бы один является металлом.
Природа затвердевших сплавов зависит от отношения друг к другу составляющих их компонентов. При сходстве кристаллических решеток они взаимно растворимы друг в друге даже в твердом состоянии. Из их расплавов при охлаждении кристаллизуются твердые растворы, представляющие собой кристаллы с решетками, в узлах которых попеременно располагаются ионы составляющих металлов, например, медь – серебро. При близости параметров кристаллических решеток составляющих металлов наблюдается их неограниченная растворимость друг в друге, т. е. могут образовываться твердые растворы с любым содержанием исходных веществ. Системы с полной взаимной растворимостью – это непрерывные твердые растворы: Ag – Au, Ni – Co, Cu – Ni, Mo – W.
Твердые растворы металлов обладают свойствами, качественно напоминающими свойства индивидуальных металлов, но количественно отличающимися от них в зависимости от состава. Например, латунь (сплав Cu – Zn) имеет прочность на разрыв, которая в 3 раза больше, чем у меди и в 6 раз, чем у цинка, а нержавеющая сталь (сплав Fe – Cr – Ni) устойчива в разбавленной H2SO4, тогда как чистый металл Fe в ней растворяется.
Среди компонентов твердого раствора различают металл-растворитель и растворенный металл. Растворителем считается металл, сохраняющий свою кристаллическую решетку при образовании раствора, и содержание которого в растворе должно быть не меньше определенного значения. Ионы растворяемого металла постепенно замещают в кристаллической решетке ионы металла-растворителя (растворы замещения) или располагаются между ними (растворы внедрения). В том случае, когда различные металлы с близкими кристаллическими решетками способны образовывать твердые растворы в любых количественных соотношениях, отличить растворенный металл от металла-растворителя нет возможности: приходится считать, что они взаимно растворяют друг друга.
Ионы растворенного металла изменяют средние размеры элементарной ячейки металла-растворителя. При образовании твердых растворов замещения параметры решетки изменяются в зависимости от разности ионных диаметров растворенного металла и растворителя. При образовании твердых растворов внедрения параметры решетки увеличиваются, так как размеры ионов растворенного металла больше межионных помежутков, в которых они располагаются.
Однако чаще всего растворимость твердых металлов друг в друге ограничена, т. е. в твердой фазе содержание одного из металлов не может превысить некий предел. В этом случае при полном затвердевании расплава из двух металлов образуется неоднородный сплав, состоящий из двух твердых фаз, одна из которых представляет собой насыщенный раствор первого металла во втором, а другая – насыщенный раствор второго металла в первом. Иногда растворимость настолько ничтожна, что отдельные твердые фазы образовавшегося сплава можно считать состоящими практически из индивидуальных металлов.
Многие металлы, взаимно растворимые в расплавленном состоянии, при охлаждении образуют смесь кристаллов с различной кристаллической решеткой. Температура плавления (Тпл) такой смеси меньше Тпл отдельных компонентов.
Состав, имеющий минимальную Тпл, называется эвтектикой. Эвтектический сплав состоит из мельчайших кристаллов индивидуальных компонентов. Его образуют металлы очень близкие по природе, но существенно отличающиеся по типу кристаллической решетки, например, Рb – Sn, Pb – Sb, Cd – Bi, Sn – Zn. Эвтектические сплавы имеют высокую твердость и прочность.
В некоторых случаях при взаимодействии двух металлов образуются химические соединения, именуемые интерметаллидами. Большинство этих соединений устойчивы только в твердом состоянии, так как их формульный состав не соответствует классическим представлениям о валентности элементов, например, TiBe12. Очень часто интерметаллиды имеют переменный состав, так как в твердом состоянии способны растворяться в металлах и других интерметаллических соединениях.
Интерметаллиды представляют собой соединения с металлической связью между входящими в их состав атомами. Термическая прочность таких соединений невысока: большинство из них при плавлении частично или полностью разлагается.
Интерметаллические соединения выглядят как металлоподобные вещества. Однако типичные для металлов физические свойства у интерметаллидов проявляются слабее. Обычно у них и электропроводность меньше, чем у компонента с низшей электрической проводимостью, и теплопроводность, и блеск, и пластичность существенно уступают соответствующим элементарным металлам. По химическим же свойствам интерметаллиды им подобны. Некоторые сравнительно прочные интерметаллические соединения в расплавленном состоянии могут подвергаться электролизу, причем на катоде выделяется более активный металл, на аноде – менее активный.
Металлические сплавы можно получить разными способами. Например, спеканием, суть которого заключается в том, что при высокой температуре и под большим давлением в смеси порошкообразных металлов осуществляется их взаимная диффузия.
Другой способ получения металлических сплавов – электролиз смеси электролитов, при котором на катоде одновременно восстанавливаются ионы двух или более металлов.
Кроме того, металлические сплавы образуются при возгонке нескольких металлов, когда из смеси паров происходит одновременная конденсация, сопровождающаяся взаимной диффузией компонентов друг в друга.
Композиционные материалы. Композиты получают путем объемного сочетания химически разнородных компонентов при сохранении между ними границы раздела. Свойства композитов существенно отличаются от свойств входящих в них компонентов.
Композиты состоят из основы (матрицы) и добавок (порошки, волокна, стружка). В качестве основы используют металлы, керамику, полимеры.
- Если основой служат металлы, то добавками могут быть металлические нитевидные кристаллы, неорганические волокна и порошки: Al2O3, SiO2 и т. д.
- Если основой является керамика, то добавками выступают металлы. Например, основа – Al2O3, Cr2O3, MgO, ZrO2 и т. д., добавки – Mo, W, Ta, Ni, Co. Такие композиты называются керамико-металлическими материалами (керметами).
Композиты характеризуются высокой прочностью, твердостью, износостойкостью, благодаря чему их используют в качестве конструкционных материалов, контактов, подшипников, инструментов и т. д.
5. Распространение в природе и способы получения металлов
Значительная часть металлов находится в земной коре в виде различных соединений, и только малоактивные (благородные) встречаются в свободном или самородном состоянии.
Содержание наиболее распространенных металлов в земной коре можно представить следующим образом (масс. %): алюминий – 8,45; железо – 4,4; кальций – 3,3; натрий – 2,6; калий – 2,5; магний – 2,1; титан – 0,61.
Из природных соединений металлов в большей степени распространены оксиды, входящие в состав горных пород, и сульфиды (железа, никеля, меди, цинка и др.). Встречаются также фториды и хлориды – преимущественно щелочных и щелочноземельных металлов. Некоторые металлы присутствуют в виде солей кислородсодержащих кислот (карбонаты, силикаты, сульфаты, фосфаты и т. д.).
Главным источником получения металлов являются руды – скопления металлосодержащих минералов, входящих в состав горных пород. Металлы в составе руд находятся в окисленном состоянии, поэтому основным способом их получения является процесс восстановления. Если в руде содержатся разные металлы, ее подвергают расщеплению на отдельные соединения металлов путем химической обработки. Так, при воздействии на полиметаллические руды хлора (в присутствии восстановителя) образуются хлориды нескольких металлов, которые благодаря разной степени летучести могут быть отделены друг от друга и от непрохлорированной части руды. Чистые хлориды ряда металлов восстанавливают активными металлами до свободных металлов.

Иногда сложные полиметаллические руды с целью получения сложных сплавов подвергают восстановлению без предварительного разделения. Поскольку они бывают загрязнены так называемой пустой породой, которая затрудняет восстановление, то процессу получения металла предшествует очистка руды или ее обогащение механическими, химическими, физико-химическими и другими методами. Из физико-химических наибольшее распространение получил метод флотации, основанный на различной смачиваемости водой частиц смеси различных материалов.
Чистые оксиды металлов легче и удобнее поддаются процессу восстановления. В связи с этим водные оксиды обезвоживают, а сульфидные руды переводят в оксидные путем окислительного обжига.
Руды с небольшим содержанием металлов подвергают гидрометаллургической переработке водными растворами кислот или щелочей. При этом соединения некоторых металлов переходят в раствор.
Таким образом, наиболее распространенными способами получения металлов являются пирометаллургия и гидрометаллургия.
1. Пирометаллургия – восстановление металлов, при котором в качестве восстановителей используют углерод (карботермия), водород, металлы-восстановители (металлотермия):
Если при восстановлении соединений металлов используется алюминий, метод получения называется алюмотермией. Алюмотермические методы применяют при извлечении из оксидов тугоплавких металлов (ванадий, хром, молибден и др.). Иногда в качестве восстановителя требуется магний. Метод магнийтермии нашел применение при получении титана, циркония, тантала из хлоридов этих металлов.
Углерод по своей восстановительной активности уступает многим металлам. Тем не менее, карботермия имеет широкое распространение при восстановлении металлов малой активности (медь) и средней (железо, цинк, свинец).
2. Гидрометаллургия – восстановление металлов, протекающее из водных растворов их солей при обычной температуре. При этом восстанавливаемый металл находится в мелкораздробленном состоянии. В качестве восстановителей используют активные металлы.
3. Электрометаллургия – процесс получения металлов под воздействием постоянного электрического тока, протекающего через раствор или расплав соли металла:
Электролизом водных растворов получают сравнительно малоактивные металлы (медь, серебро, никель и т. д.). А электролизом расплавов солей – высокоактивные (щелочные и щелочноземельные металлы, алюминий).
Получение чистых металлов. Некоторые отрасли промышленности и техники нуждаются в металлах особой чистоты. Например, они востребованы при конструировании ядерных реакторов, в электронной и медицинской технике. Особо чистые металлы отличаются по своим физическим свойствам от обычных. Такие свойства, как пластичность, электро- и теплопроводность, а также сопротивление коррозии у чистых металлов имеют более высокие значения.
В настоящее время проблема получения чистых и сверхчистых металлов решается разными способами.
Активные металлы

Металлы, легко вступающие в реакции, называются активными металлами. К ним относятся щелочные, щелочноземельные металлы и алюминий.
Положение в таблице Менделеева
Металлические свойства элементов ослабевают слева направо в периодической таблице Менделеева. Поэтому наиболее активными считаются элементы I и II групп.
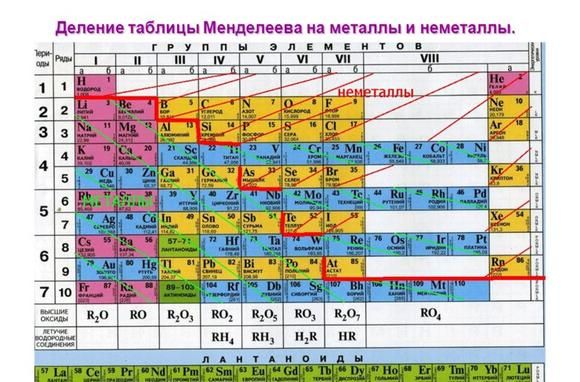
Рис. 1. Активные металлы в таблице Менделеева.
Все металлы являются восстановителями и легко расстаются с электронами на внешнем энергетическом уровне. У активных металлов всего один-два валентных электрона. При этом металлические свойства усиливаются сверху вниз с возрастанием количества энергетических уровней, т.к. чем дальше электрон находится от ядра атома, тем легче ему отделиться.
Наиболее активными считаются щелочные металлы:
- литий;
- натрий;
- калий;
- рубидий;
- цезий;
- франций.
К щелочноземельным металлам относятся:
- бериллий;
- магний;
- кальций;
- стронций;
- барий;
- радий.
Узнать степень активности металла можно по электрохимическому ряду напряжений металлов. Чем левее от водорода расположен элемент, тем более он активен. Металлы, стоящие справа от водорода, малоактивны и могут взаимодействовать только с концентрированными кислотами.

Рис. 2. Электрохимический ряд напряжений металлов.
К списку активных металлов в химии также относят алюминий, расположенный в III группе и стоящий левее водорода. Однако алюминий находится на границе активных и среднеактивных металлов и не реагирует с некоторыми веществами при обычных условиях.
Свойства
Активные металлы отличаются мягкостью (можно разрезать ножом), лёгкостью, невысокой температурой плавления.
Основные химические свойства металлов представлены в таблице.
Реакция
Уравнение
Исключение
Щелочные металлы самовозгораются на воздухе, взаимодействуя с кислородом
Литий реагирует с кислородом только при высокой температуре
Щелочноземельные металлы и алюминий на воздухе образуют оксидные плёнки, а при нагревании самовозгораются
Реагируют с простыми веществами, образуя соли
Алюминий не вступает в реакцию с водородом
Бурно реагируют с водой, образуя щёлочи и водород
Реакция с литием протекает медленно. Алюминий реагирует с водой только после удаления оксидной плёнки
Реагируют с кислотами, образуя соли
Взаимодействуют с растворами солей, сначала реагируя с водой, а затем с солью
Активные металлы легко вступают в реакции, поэтому в природе находятся только в составе смесей – минералов, горных пород.

Рис. 3. Минералы и чистые металлы.
Что мы узнали?
К активным металлам относятся элементы I и II групп – щелочные и щелочноземельные металлы, а также алюминий. Их активность обусловлена строением атома – немногочисленные электроны легко отделяются от внешнего энергетического уровня. Это мягкие лёгкие металлы, быстро вступающие в реакцию с простыми и сложными веществами, образуя оксиды, гидроксиды, соли. Алюминий находится ближе к водороду и для его реакции с веществами требуются дополнительные условия – высокие температуры, разрушение оксидной плёнки.
Химические свойства металлов

Основным химическим свойством металлов является способность их атомов легко отдавать свои валентные электроны и переходить в положительно заряженные ионы.
Типичные металлы никогда не присоединяют электронов; их ионы всегда заряжены только положительно. Поэтому металлы называются «электроположительными» элементами, в отличие от «электроотрицательных» элементов — металлоидов, для которых более характерна способность при соединять электроны.
Удельный вес и температура плавления некоторых металлов
Почему типичные металлы восстановители
Легко отдавая при химических реакциях свои валентные электроны, типичные металлы являются энергичными восстановителями.
Способность к отдаче электронов проявляется у отдельных металлов далеко не в одинаковой степени. Чем легче металл отдает свои электроны, тем он активнее, тем энергичнее вступает во взаимодействие с другими веществами.
Для сравнительного изучения активности металлов можно воспользоваться различными реакциями. Особенно удобны для этой цели реакции вытеснения металлов из их солей другими металлами. Опустим, например, кусочек цинка в раствор какой-нибудь свинцовой соли. Цинк начинает растворяться, а из раствора выделяется свинец. Реакция выражается уравнением
или в ионной форме
Zn + Pb •• = Pb + Zn ••
Из уравнения видно, что эта реакция является типичной реакцией окисления-восстановления. Сущность ее сводится к тому, что атомы цинка отдают свои валентные электроны ионам Рb •• , тем самым превращаясь в ионы Zn •• , а ионы Рb •• разряжаются и выделяются в виде металлического свинца. Если поступить наоборот, т. е погрузить кусочек свинца в раствор цинковой соли, то никакой реакции не произойдет. Это показывает, что цинк более активен, чем свинец, что его атомы легче отдают, а ионы труднее присоединяют электроны, чем атомы и ионы свинца.
Сравнивая таким же способом активность свинца и меди, легко убедиться, что свинец более активен, чем медь, так как он вытесняет медь из ее солей, а медь не может вытеснять свинец:
Рb + Cu •• = Сu + Рb ••
Следовательно, из трех сравниваемых металлов — цинка, свинца и меди — наиболее активным, легче других отдающим электроны, является цинк, менее активен свинец и еще менее активна медь.
Вытеснение металлов из соединений металлами
Вытеснение одних металлов из их соединений другими металлами впервые было подробно изучено Н. Н. Бекетовым (1865 г.), расположившим металлы по их убывающей химической активности в так называемый «вытеснительный ряд». В настоящее время вытеснительный ряд Бекетова носит название ряда напряжений, так как положение каждого металла в ряду точно определяется величиной электрического напряжения, или разности потенциалов, возникающей при погружении данного металла в раствор его соли. Об измерении этих величин и их значении будет сказано несколько позже.
Для наиболее важных металлов ряд напряжений, как уже было указано , имеет следующий вид:
Уменьшение химической активности нейтральных атомов
К, Na, Са, Mg, Al, Mn, Zn, Fe, Ni, Sn, Pb, H2, Cu, Hg, Ag, Au
Уменьшение способности ионов к присоединению электронов
В этом ряду помещен и водород, так как он тоже может вытеснять некоторые металлы из растворов их солей и в свою очередь вытесняется многими металлами из растворов кислот.
Определения положения водорода в вытеснительном ряду
Для определения положения водорода в «вытеснительном ряду» Бекетовым производились следующие опыты. В колена изогнутой стеклянной трубки (рис.) помещали отдельно друг от друга раствор соли металла, кислоту и цинк. Трубку запаивали» затем наклоняли ее так, что цинк падал в кислоту и выделяющийся водород действовал под давлением на раствор соли.
Наблюдая явления, происходящие в колене трубки, наполненном раствором соли, можно было судить о том, вытесняется ли металл водородом. На основании проведенных опытов Бекетов пришел к заключению, что в «вытеснительном ряду» водород занимает место после свинца и может вытеснять(восстанавливать) следующие за ним металлы: медь, ртуть, серебро, золото из растворов их солей.
Бекетов был убежден, что реакции вытеснения водорода металлами являются обратимыми и что для каждого металла должно существовать такое давление, при котором направление реакции меняется на обратное, т. е. водород начинает вытеснять металл из раствора его соли.
Взгляды Бекетова получили позднее полное подтверждение.
Рассмотрим, например, реакцию вытеснения водорода цинком:
Константа равновесия этой реакции выражается следующей формулой:
где вместо концентрации водорода взято его давление рн2 в атмосферах. Вычисление показывает, что при обычной температуре К = 36 • 10 24 . Значит, потребовалось бы недостижимое при современной технике давление водорода, чтобы сделать ощутимой обратную реакцию, т. е. вытеснение цинка водородом. При обычном же давлении равновесие реакции практически нацело смещено вправо.
Однако для реакции
Sn + 2H • ⇄ Sn •• + H2
Это значит, что равновесие будет достигнуто, например, при концентрациях: [Sn •• ]= l г-ион/л,[Н • ] = 0,01 г-ион/л и давлении водорода рн2 = 4 ат. Следовательно, при сравнительно небольшом давлении водород может вытеснить олово из раствора его соли.
Электрохимический ряд напряжений
Ряд напряжений дает много общих указаний относительно химического поведения отдельных металлов при реакциях в растворах:
- Каждый металл этого ряда, а также и водород, находящийся под давлением, вытесняет (восстанавливает) все следующие за ним металлы из растворов их солей. В свою очередь сам он может быть вытеснен (восстановлен) любым из металлов, стоящих впереди него.
- Только те металлы, которые стоят в ряду напряжений впереди водорода, могут вытеснять его из разбавленных кислот («солей водорода»). Металлы, стоящие вправо от водорода, не способны вытеснять водород из кислот.
- Чем левее в ряду напряжений стоит металл, тем он активнее, тем больше его восстановительная способность в отношении ионов других металлов, тем легче он сам превращается в ионы, тем труднее восстанавливаются его ионы.
Вы читаете, статья на тему Химические свойства металлов
Похожие страницы:
Вытеснительный ряд металлов Бекетова Рассматривая способы получения водорода, мы уже отмечали, что одни металлы легко вытесняют из воды водород, другие —.
Ряд активности металлов это последовательность в которой металлы расположены в порядке увеличения их стандартных электрохимических потенциалов. Металлы в ряду активности.
Химические свойства воды Из химических свойств воды прежде всего следует отметить большую устойчивость ее молекул по отношению к нагреванию. Однако.
Водород в природе Водород (Hydrogenium; ат. вес 1,008) в свободном состоянии встречается в природе лишь в незначительных количествах, главным образом.
Содержание статьи1 Химические уравнения и расчеты по ним1.1 Что такое химические уравнения1.2 Для чего нужны химические уравнения1.3 Пример решения химического.
Соединения фосфора с водородом и галогенами С водородом фосфор образует три соединения: РН3 — газообразный фосфористый водород, Р2Н4 — жидкий фосфористый.
Источник https://extxe.com/16319/metally-svojstva-harakteristiki-metallov/
Источник https://obrazovaka.ru/himiya/aktivnye-metally-spisok.html
Источник https://znaesh-kak.com/x/x/%D1%85%D0%B8%D0%BC%D0%B8%D1%87%D0%B5%D1%81%D0%BA%D0%B8%D0%B5-%D1%81%D0%B2%D0%BE%D0%B9%D1%81%D1%82%D0%B2%D0%B0-%D0%BC%D0%B5%D1%82%D0%B0%D0%BB%D0%BB%D0%BE%D0%B2





